|
 |
||||||
|
|
首 页 | 公司简介 | 产品展示 | 加盟合作 | 科普园地 | 联系我们 | 产品购买 |
|
|
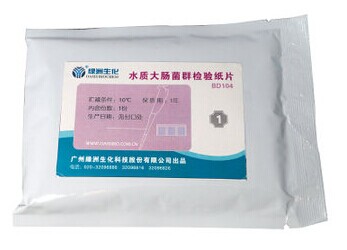
水质(粪)大肠菌群快速检验纸片
分BD105Ⅰ和BD105Ⅱ两个型号,请注意选择型号。 1、适用范围 水质(粪)大肠菌群的测定纸片快速法 本标准规定了总大肠菌群、粪大肠菌群的快速测定方法。 本标准适用于地表水、生活污水、医疗机构及禽畜养殖业等其他行业排放的废水中(粪)大肠菌群的快速筛查。 本方法的检出限为20MPN/L。 2、 2、规范性引用文件 本标准内容引用了下列文件或其中的条款。凡是不注明日期的引用文件,其有效版本适用于本标准。HJ/T91地表水和污水监测技术规范 3、 3、术语和定义 下列术语和定义适用于本标准。 3.1总大肠菌群(total coliforms) 在37℃培养,24h内能发酵乳糖酸产气的需氧及兼性厌氧的革兰氏阴性无芽胞杆菌。
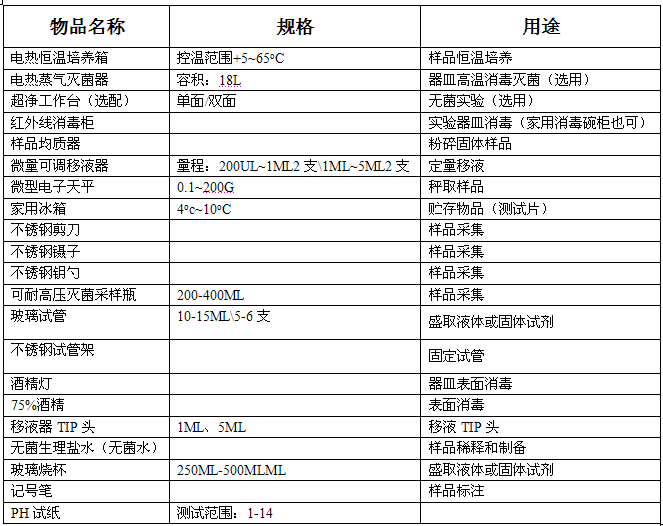
3.2 粪大肠菌群(fecal coliforms) 44.5℃培养,24h内能发酵乳糖产酸气的总大肠菌群,属粪行来源,称为粪大肠菌群。 4、方法原理 将一定量的乳糖、指示剂(溴甲酚紫和2,3, 5-氯化三苯基四氮唑即TTC)以及营养成分等吸附于一定面积的无菌滤纸上,当细菌生长繁殖时,产酸使PH值降低,溴甲酚紫指示剂由紫色变黄色。同时,产气过程相应的脱氢酶在适宜的PH范围内,催化底物脱氢还原TTC形成红色的不溶性三苯甲臜(TTF),即可在产酸后的黄色背景下显示出红色斑点(或红晕)。通过上述指示剂的颜色变化就可对是否产酸产气作出判断,从而确定是否有(粪)大肠菌群存在,再通过查MPN表就可得出相应(粪)大肠菌群的浓度值。 5、试剂和材料 除非另有说明,分析时均使用符合国家标准的分析纯化学试剂。 5.1市售水质总大肠菌群、粪大肠菌群测试片:10ml水样量纸片按附录A的方法进行质量鉴定,达到要求后方可使用。 5.2无菌水 用新制备的去离子水或蒸馏水,按无菌操作要求,121℃高压蒸汽灭菌20min,备用。 5.3硫代硫酸钠溶液:ρ(Na2S2O3)=0.10g/ml 称取硫代硫酸钠10g,溶于适量蒸馏水(或去离子)中,稀释至100ml,现配。 5.4乙二胺四乙酸二钠(EDTA- Na2)溶液:ρ(C10H14N2O8Na2。 2H2O)=0.15g/ml 称取EDTA-Na2 15g,溶于适量蒸馏水(或去离子水)中,稀释至100ml,此溶液保质期为30d。 6 6、 仪器和设备 6.1 恒温培养箱:37℃±1℃。 6.2 恒温培养箱:44℃±0.5℃。 6.3 高压蒸汽灭菌器:121℃、101.3kpa。 6.4 冰箱:0-4℃ 6.5 移液管:1±0.01ml、10±0.1ml。 6.6 试管:φ15mm×150mm. 6.7 采样瓶:500ml。 注1:移液器、试管、采样瓶等玻璃器皿实验前要按无菌操作要求包扎,121℃高压蒸汽灭菌20min,烘干,备用。
6 7、样品 用灭菌器具,按照HJ/T 91的规定及无菌操作的要求,采集水样400ml放入已灭菌的采样瓶中。如果是经加氯处理的废水,需在采样瓶灭菌前加入乙二胺四乙酸二钠(EDTA- Na2)溶液(5.4)1.2ml,以消除干扰。酸性样品,需调节胖胖的PH值至7.0-8.0。 采样后2h内检测,否则,需10℃以下冷藏并6h内送检,实验室接样后,应将样品放入0-4℃冰箱并2h内测定。 注2:10mg硫代硫酸钠可保证去除水样中1.5mg余氯,硫代硫酸钠用量克根据水样实际余氯量调整。
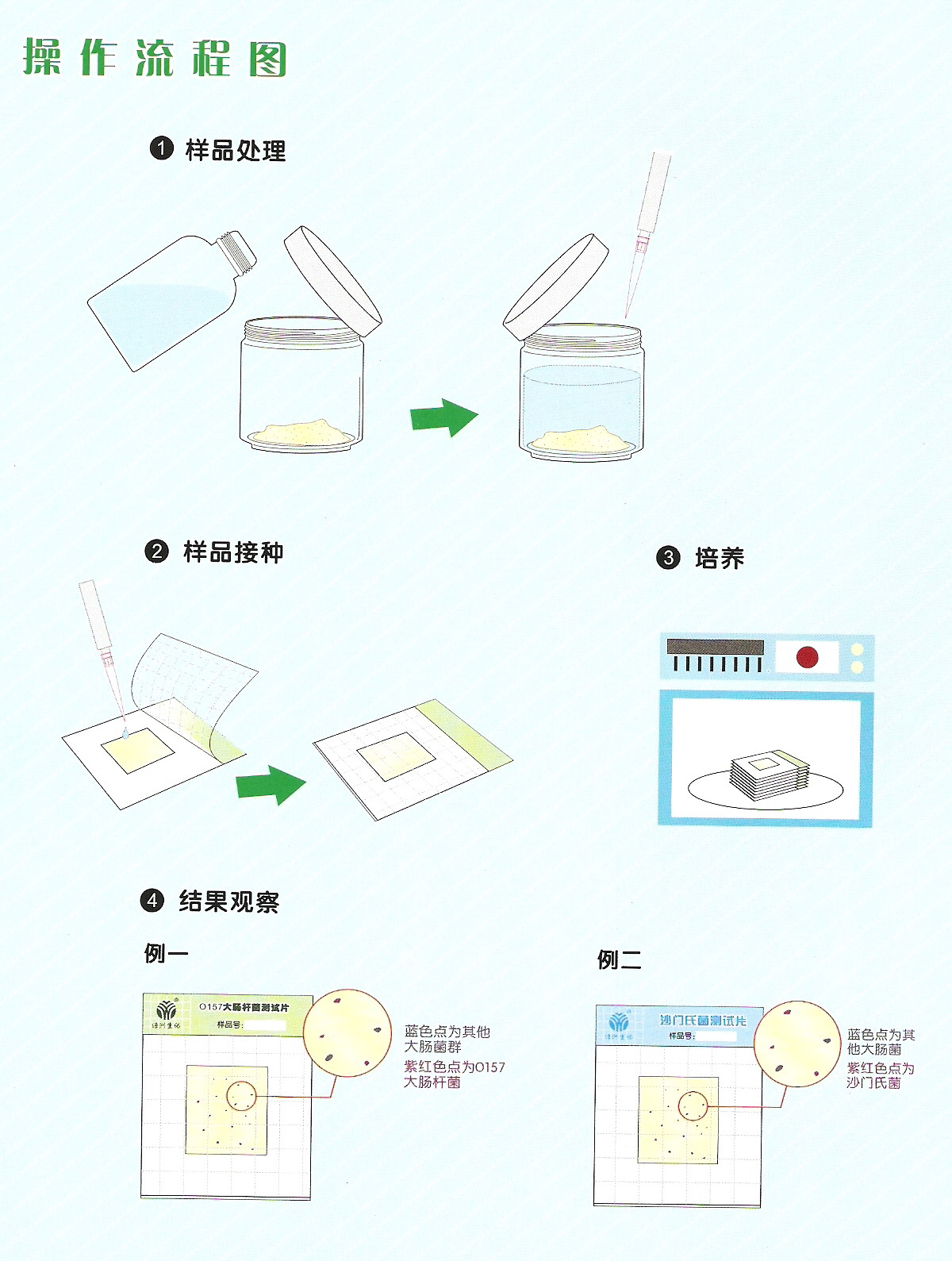
7 8、分析步骤 8.1接种量 每个样品按三个不同的接种量接种,每个接种量分别接种5张纸片,共接种15张纸片。 根据水样的污染程度确定接种量,应尽可能使5个接种量最大的纸片为阳性、5个接种量最小的纸片为阴性。 清洁水样的参考接种量分别为10 ml、1 ml、0.1 ml,受污染水样参考接种量根据污染程度可接种1 ml、0.1ml、0.01 ml或0.1 ml、0.01 ml、0.001 ml等,见下表1。 表1水样接种量参考表 接种量小于1ml时,水样应制成稀释样品后使用。接种量为0.1ml、0.01 ml时,分别制成1:10稀释样品、1:100稀释样品。其它接种量的稀释样品依次类推。 1:10稀释样品的制作方法为:吸取1ml水样,注入盛有9 ml无菌水的试管中,混匀,制成1:10稀释样品。其它稀释度的稀释样品同法制作。
8.2接种、培养 水样充分混匀,按无菌操作制作稀释水样及接种水样。 清洁水样,接种水样总量为55.5ml,10 ml水样量纸片5张,每张接种水样10ml,1 ml水样量纸片10张,其中5张各接种水样1ml,另5张各接种1:10的稀释水样1ml。受污染水样,接种3个不同稀释度的1ml稀释水样各5张。 接种水样应均匀涂布于纸片上,纸片充分侵润、吸收水样,用手轻轻压平,做好标记。 测总大肠菌群时,在37±1℃的条件下培养18-24h后观察结果;测粪大肠菌群时,在44.5±0.5℃的条件下培养18-24h后观察结果。 注3:1、检测粪大肠菌群时,纸片接种后应立即放置于44.5±0.5℃的恒温培养箱中培养,在常温下放置过久将影响检测结果的准确性。 2、纸片加入水样后,短时间内变黄或退色,表明水样存在酸性物质活氧化剂干扰,需按“7样品”一节方法去除相应干扰。
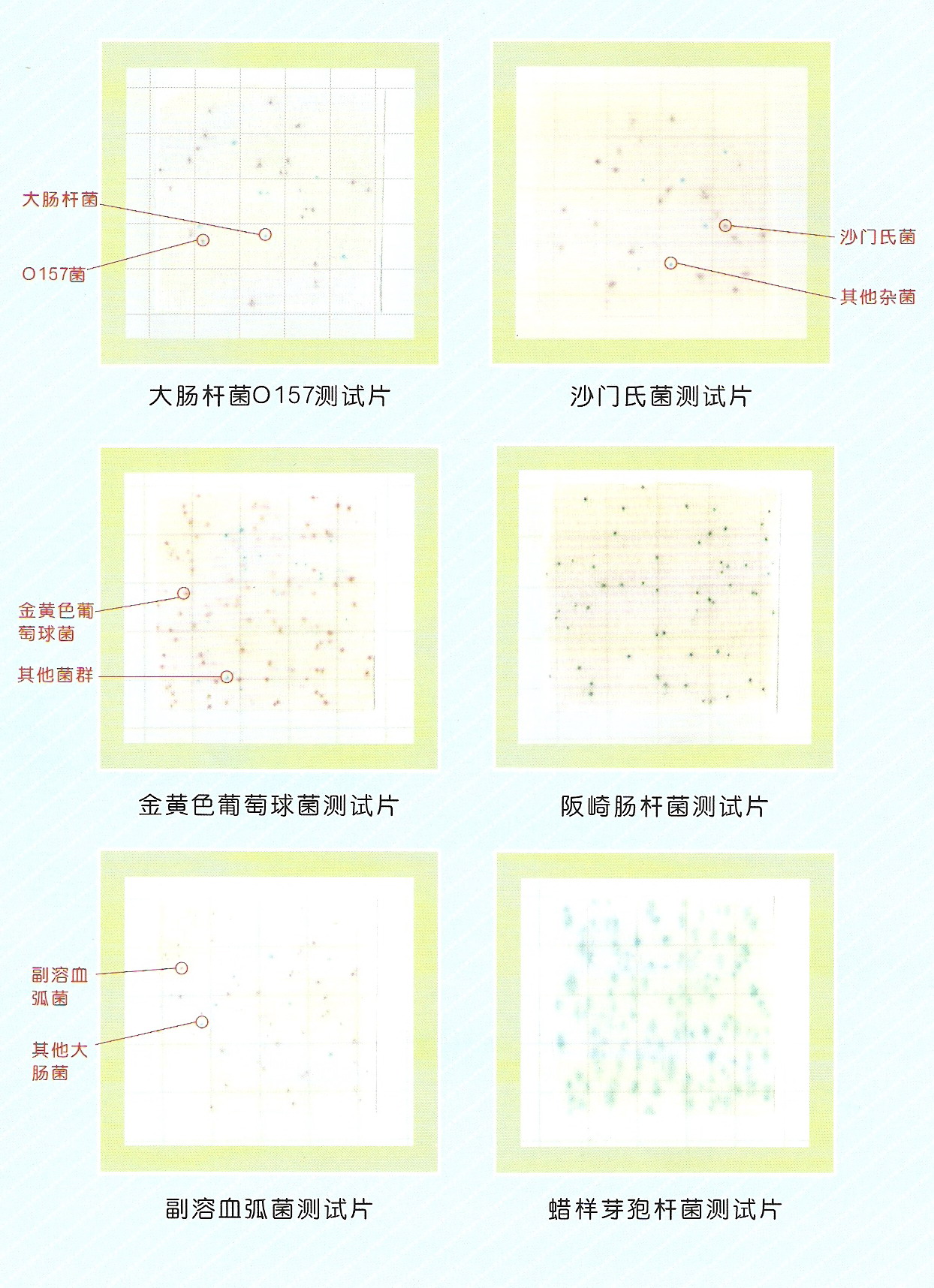
8.3结果判定 (1)纸片上出现红斑或红晕且周围变黄,为阳性。 (2)纸片全片变黄,无红斑或红晕,为阳性。 (3)纸片部分变黄,无红斑或红晕,为阴性。 (4)纸片的紫色背景上出现红斑或红晕,而周围不变黄,为阴性。 (5)纸片无变化,为阴性。 结果判断参照图片见附录B。 6 9、结果计算与表示 6.1 9.1结果计算 根据不同接种量的阳性纸片数量,查MPN表(附录C),经下面的公司换算报告1L水中(粪)大肠菌群数: 6.2 9.2结果表示 测定结果保留二位有效数字,大于100时以科学计数法表示,结果的单位为MPN/L。平均值以几何平均计算。 7 10、 精密度和准确度 微生物检测书记为偏态分布,按其统计分析要求,其检测所得MPN值全部经对数(以10为底)转换后进行以下分析。 10.1精密度 6家实验室分别对有证标准样品(15600MPN/L)、低浓度(4.0×102 MPN/L)、中浓度(1.0×104 MPN/L)、高浓度(8.0×104MPN/L)实际样品的总大肠菌群进行了测定,实验室内相对标准偏差范围分别为:4.5%~7.5%、3.5%~12.4%、4.5%~6.9%、2.8%~5.8%;实验室间的相对标准偏差范围分别为:3.3%、12.6%、4.6%、1.6%;重复限为0.61、0.67、0.67、0.64;再现性限为1.09、0.81、0.66、0.69。 6家实验室分别对有证标准样品(12100MPN/L)、低浓度(1.0×102 MPN/L)、中浓度(4.0×103 MPN/L)、高浓度(5.0×104 MPN/L)实际样品的粪大肠菌群进行了测定,实验室内的相对标准偏差范围分别为:4.5%~11.3%、11.4%~31.3%、2.8%~21.5%、3.9%~13.2%;实验室间的相对标准偏差分别为5.2%、14.8%、11.9%、8.2%。重复性限为0.93、0.83、0.85、0.77;再现性限为1.28、1.44、1.35、0.89。 10.2 10.2准确性 6家实验室对总大肠菌群有证标准样品(15600MPN/L)进行测定,实验室内相对误差的范围是-5.5%~-12.8%,相当误差的最终值为-8.8%±6.0%。 6家实验室对粪大肠菌群有证标准样品(12100MPN/L)进行测定,实验室内相对误差的范围是-3.8%~-16.0%,相对误差的最终值为-10.3%±9.2%。 11 11、 质量保证和质量控制 11.1应使用质量鉴定合格的纸片。 11.2每批样品应用无菌水做全程序空白测定,培养后的纸片上不的有任何微生物生长,否则,该次样品测定结果无效,应查明原因后重新测定。 11.3每批样品应使用有证标准菌株进行阳性、阴性对照试验。总大肠菌群测定的阳性菌株为大肠埃希氏菌,阴性菌株为金黄色葡萄菌;粪大肠菌群测定的阳性菌株为大肠埃希氏菌,阴性菌株为产气肠杆菌。 上述标准菌株均制成浓度为300~3000个/ml的菌悬液,分别取相应水量的菌悬液接种纸片,按“8.2接种、培养”一节的要求培养,大肠埃希氏菌应呈现阳性反应;金黄色葡萄球菌、产气肠杆菌应呈现阴性反应,否则,该次样品测定结果无效,应查明原因后重新测定。 12 12、废弃处理 使用后的器皿及废弃物须用121℃高压蒸汽灭菌20min后,器皿方可清洗,废弃物作为普通垃圾处理。
微生物 快速检测产品展示
|
|
版权所有
© 莱特企业 & 广州奥联环保科技有限公司
|